1. Số mol CO2 = \(\dfrac{{2,24}}{{22,4}}\) = 0,1 (mol).
Số mol H2O = \(\dfrac{{2,25}}{{18}}\) =0,125 (mol).
Khi đốt ancol A, số mol H2O tạo thành > số mol CO2. Vậy, A phải là ancol no, mạch hở. A có dạng CnH2n+2-x(OH)x hay CnH2n+2Ox.
\({C_n}{H_{2n + 2}}{O_x} + \dfrac{{3n + 1 - x}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
Theo đầu bài ta có : \(\dfrac{n}{{n + 1}} = \dfrac{{0,1}}{{0,125}}\) \( \Rightarrow \) n = 4.
\({C_4}{H_{10 - x}}{(OH)_x} + xNa \to {C_4}{H_{10 - x}}{(ONa)_x} + \dfrac{x}{2}{H_2}O\)
Theo phương trình : Cứ (58 + 16x) g A tạo ra 0,5000x mol H2.
Theo đầu bài : Cứ 18,55 g A tạo ra \(\dfrac{{5,88}}{{22,4}}\) = 0,2625 mol H2.
\( \Rightarrow \dfrac{{58 + 16{\rm{x}}}}{{18,55}} = \dfrac{{0,5{\rm{x}}}}{{0,2625}} \Rightarrow x = 3\)
CTPT của A là C4H10O3.
Theo đầu bài A có mạch cacbon không nhánh ; như vậy các CTCT thích hợp là
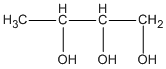 butan-1,2,3 triol
butan-1,2,3 triol
và 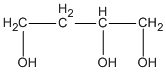 butan-1,2,4-triol.
butan-1,2,4-triol.
2. Để tạo ra 0,1 mol CO2 ; số mol A cần đốt là : \(\dfrac{{0,1}}{4}\) = 0,025 (mol).
Như vậy : m = 0,025.106 = 2,65 (g).