Đề số 2 - Đề kiểm tra học kì 2 - Hóa học 10
Câu 1. Clorua vôi là muối của canxi với hai gốc axit là clorua (Cl-) và hipoclorit (ClO-). Vậy clorua vôi được gọi là
A.muối trung hòa.
B.muối hỗn tạp.
C.muối axit.
D. muối kép.
Câu 2. Cho một lượng dư dung dịch AgNO3 tác dụng với 100 ml dung dịch chứa hỗn hợp NaF 0,4M, NaBr 0,5M và NaCl 0,2M. Khối lượng kết tủa thu được là
A.12,27 gam.
B.17,35 gam.
C.9,4 gam.
D.13,6 gam.
Câu 3. Cho cân bằng hóa học sau:
\({N_2}\left( k \right) + {O_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2NO\left( k \right),\Delta H > 0.\)
Các yếu tố ảnh hưởng đến cân bằng là
A.nhiệt độ.
B.áp suất.
C.chất xúc tác.
D.Cả A, B, C.
Câu 4. Cho phản ứng:
\(Na{X_{\left( r \right)}} + {H_2}S{O_{4\left( d \right)}} \to NaHS{O_4} + HX.\)
Vậy HX có thể là
A.HI, HBr. B.HCl, HBr.
C.HF, HI D.HF, HCl.
Câu 5. Tiến hành thí nghiệm sau: cho một mảnh giấy quỳ tím vào dung dịch NaOH loãng, sau đó sục khí clo vào dung dịch đó. Hiện tượng xảy ra trong thí nghiệm trên là
A.giấy quỳ từ màu tím chuyển sang màu xanh.
B.giấy quỳ từ màu xanh chuyển sang không màu.
C.giấy quỳ từ màu xanh chuyển sang màu hồng.
D.giấy quỳ từ màu hồng chuyển sang không màu.
Câu 6. Cho các phản ứng sau:
\(\eqalign{ & A.C{l_2} + KBr \to {\rm{ B}}{\rm{.}}{{\rm{K}}_2}C{r_2}{O_7} + HC{l_{\left( d \right)}} \to \cr & C.NaC{l_{\left( r \right)}} + {H_2}S{O_{4\left( d \right)}} \to {\rm{ D}}{\rm{.B}}{{\rm{r}}_2} + {H_2}O + S{O_2} \to \cr} \)
Số phản ứng tạo ra đơn chất là
A.1. B.2.
C.3. D.4.
Câu 7. Cho các mệnh đề sau
(1)Khí clo đẩy được brom ra khỏi dung dịch NaBr.
(2)Các muối bạc halogenua đều không tan trong nước.
(3)Các nguyên tố halogen thường có các số oxi hóa là -1, 0, +1, +3, +5, +7.
(4)Flo là phi kim có tính oxi hóa mạnh nhất.
(5)Thuốc thử để nhận biết iot là phenolphtalein.
(6)Hiđro florua tan nhiều trong nước tạo thành dung dịch axit yếu.
Số mệnh đề không đúng là
A.2. B.3.
C.4. D.5.
Câu 8. Hòa tan hoàn toàn 17,5 gam hỗn hợp gồm Al, Mg và Fe trong dung dịch H2SO4 loãng, dư thu được 11,2 lít khí H2 (đktc) và dung dịch B. Khối lượng muối khan thu được khi cô cạn dung dịch B là
A.65,5 gam. B.114,5 gam
C.55,6 gam. D.56,5 gam.
Câu 9. Có ba khí HCl, H2, Cl2 được đựng trong các bình mất nhãn. Thuốc thử nào sau đây được dùng để phân biệt ba bình khí trên?
A.Dung dịch phenolphtalein.
B.Quỳ tím ẩm.
C.Dung dịch AgNO3.
D.Không phân biệt được.
Câu 10. Sự chuyển dịch cân bằng là
A.phản ứng trực tiếp theo chiều thuận.
B.Phản ứng trực tiếp theo chiều nghịch.
C.Sự chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác.
D.Phản ứng tiếp tục xảy ra cả ở chiều thuận và chiều nghịch.
Câu 11. Cho phản ứng: \({H_2}\left( k \right) + C{l_2}\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2HCl\left( k \right),\Delta H < 0.\)
Cân bằng chuyển dịch theo chiều nghịch khi tăng
A.nhiệt độ.
B.áp suất.
C.nồng độ H2.
D.nồng độ Cl2.
Câu 12. Cho hỗn hợp gồm Mg, Cu vào cốc đựng dung dịch H2SO4 loãng, vừa đủ thu được chất khí X, dung dịch chứa muối Y và chất rắn không tan Z. Các chất X, Y, Z lần lượt là
\(\eqalign{ & A.{H_2},MgS{O_4},Cu. \cr & B.{H_2},CuS{O_4},Mg. \cr & C.{H_2},MgS{O_4},CuS{O_4}. \cr & D.S{O_2},MgS{O_4},Cu. \cr} \)
Câu 13. Khí lưu huỳnh đioxit là chất khí không màu, mùi hắc và là một khí độc. Khí SO2 xâm nhập vào cơ thể qua đường hô hấp hoặc hòa tan với nước bọt, từ qua đường tiêu hóa ngấm vào nhau. Trong máu, SO2 tham gia nhiều phản ứng hóa học làm giảm dự trữ kiềm trong máu gây rối loạn chuyển hóa đường và protein, gây thiếu vitamin B và c, tạo ra methemoglobine (MetHb) chuyển Fe2+ ( hòa tan ) thành Fe3+ (kết tủa) gây tăc nghẽn mạch máu cũng như làm giảm khả năng vận chuyển oxi của hồng cầu, gây co hẹp dây thanh quản, khó thở. Khi tiến hành các thí nghiệm sinh ra SO2, để đảm bảo an toàn cho sức khỏe, người ta thường dùng biện pháp nào sau đây?
A.Đun nhỏ lửa để lượng khí thoát ra chậm.
B.Đặt lên miệng bình thu khí một miếng bông tẩm nước.
C.Đặt lên miệng bình thu khí một miếng bông tẩm xút.
D.Úp bình thu khí.
Câu 14. Hòa tan hoàn toàn 22,2 gam hỗn hợp gồm Al và Fe trong dung dịch H2SO4 đặc, nóng, dư. Sau khi phản ứng xảy ra hoàn toàn thu được 16,8 lít khí SO2 (đktc, sản phẩm khử duy nhất) và dung dịch B. Thành phần phần trăm về khối của của Al và Fe trong hỗn hợp ban đầu là
A.24,32% và 75,68%.
B.75,68% và 24,32%.
C.42,2% và 57,8%.
D.57,8% và 42,2%.
Câu 15. Khi nhiệt độ tăng lên \(10^\circ C\) , tốc độ một phản ứng hóa học tăng lên 2 lần. Tốc độ phản ứng đó thay đổi như thế khi nhiệt độ giảm từ \(70^\circ C\) xuống \(40^\circ C\) ?
A.Giảm 8 lần.
B.Tăng 6 lần.
C.Tăng 8 lần.
D.Giảm 6 lần.
Câu 16. Axit sunfuric đặc có thể tác dụng với các chất trong dãy nào sau đây?
\(\eqalign{ & A.Cu,Ba{\left( {OH} \right)_2},CaC{O_3},F{e_2}{O_3}. \cr & B.Au,NaOH,BaC{l_2},CuO. \cr & C.N{a_2}S{O_4},{K_2}S,Mg{\left( {OH} \right)_2},AgN{O_3}. \cr & D.Ag,S{O_2},Fe{\left( {OH} \right)_3},AgN{O_3}. \cr} \)
Câu 17. Khẳng định nào dưới đây là đúng?
A.Hợp chất freon (CFC) khi thoát ra môi trường gây phá hủy tầng ozon.
B.Các halogen khi ở nhiệt độ thường đều là chất khí.
C.Axit sunfuric đặc, nguội có thể phản ứng với hầu hết các kim loại trừ vàng và platin.
D.SO3 là một oxit lưỡng tính.
Câu 18. Hấp thụ hoàn toàn 4,48 lít khí H2S (đktc) vào 200 ml dung dịch NaOH 1,5M. Nồng độ của các dung dịch sau phản ứng là.
A.Na2S 0,5M và NaOH 0,5M.
B.Na2S 0,5M và NaHS 0,5 M.
C.NaHS 0,1M.
D.Na2S 0,1M.
Câu 19. Cho hệ phản ứng sau ở trạng thái cân bằng:
\(2S{O_2}\left( k \right) + {O_2}\left( k \right) \to 2S{O_3}\left( k \right),\Delta H < 0.\)
Chọn phát biểu đúng trong các câu sah theo
A.Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ của SO3.
B.Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất của hệ phản ứng.
C.Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ.
D.Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ của O2.
Câu 20. Để điều chế oxi từ KMnO4, có thể dùng dụng cụ nào sau đây trong phòng thí nghiệm?
A. Ống đong.
B. Bình kíp.
C. Bình cầu có nhánh.
D. Cốc thủy tinh.
Câu 21. Cho hình vẽ sau
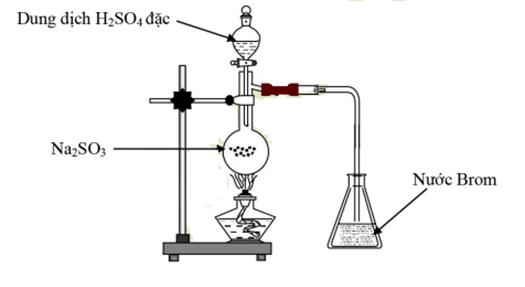
Khí thoát ra khỏi bình cầu và hiện tượng xảy ra trong erlen chứa brom là
A.SO2, dung dịch brom không đổi màu.
B.SO3, không có hiện tượng.
C.SO2, dung dịch brom mất màu.
D.SO2, có kết tủa màu đỏ.
Câu 22. Hòa tan hoàn toàn 30,5 gam hỗn hợp gồm ZnO, Fe2O3 và FeO bằng 100 ml dung dịch axit HCl aM. Cô cạn dung dịch thu được sau phản ứng thu được 66,5 gam mưới khan. Giá trị của a là?
A.1,5. B.2,5.
C.3,5. D.4,5.
Câu 23. Cho 13,05 gam MnO2 tác dụng với HCl đặc (dư). Khí thoát ra được hấp thụ hết vào 400 ml dung dịch NaOH 1M ở nhiệt độ thường. Nồng độ các chất trong dung dịch sau phản ứng là
A.NaOH 0,375M; NaClO 0,375M; NaOH 0,25M.
B.NaCl 0,75M; NaOH 0,25M.
C.NaCl 0,375M; NaClO 0,375M.
D.NaClO 0,75M; NaOH 0,25M.
Câu 24. Cho các nhận định sau
(1)Các khí có thể cùng tồn tại trong một hỗn hợp là SO2 và O2.
(2)Điện phân dung dịch muối ăn không có màng ngăn thu được H2 và nước Javen.
(3)Để điều chế F2 ta có thể dùng phương pháp đun KF với H2SO4 đặc, ở nhiệt độ cao.
(4)Trong phòng thí nghiệm, người ta bảo quản dung dịch HF trong các lọ bằng thủy tinh.
(5)Khí hidro sunfua tan nhiều trong nước tạo thành dung dịch axit yếu.
(6)Trong phòng thí nghiệm, để điều chế một lượng khí oxi, ta có thể tiến hành nhiệt phân kali pemanganat (KMnO4).
Số nhận định đúng là
A.2. B.3.
C.4. D.5.
Câu 25. Một hỗn hợp khí gồm Cl2, O2, CO2, SO2. Để thu được O2 tình khiết, người ta dẫn hỗn hợp khí trên đi qua
A.nước clo.
B.nước brom.
C.dung dịch NaOH.
D.dung dịch HCl.
Câu 26. Muốn khắc thủy tinh người ta nhúng thủy tinh vào sáp nóng chảy, nhấc ra cho nguội, dùng vật nhọn khắc hình ảnh mong muốn lên bề mặt, sau đó nhỏ dung dịch axit flohidric vào. Khi đó thủy tinh sẽ bị ăn mòn ở những vị trí không có lớp sáp. Nếu không có dung dịch axit flohidric thì có thể dùng hỗn hợp nào sau đây?
A. NaF và HCl đặc.
B. CaF2 và HCl loãng.
C. NaF và H2SO4 đặc.
D. CaF2 và HCl đặc.
Câu 27. Cho phản ứng sau
\(F{e_{\left( r \right)}} + 2HC{l_{\left( {{\rm{dd}}} \right)}} \to FeC{l_2}_{\left( {{\rm{dd}}} \right)} + {H_{2\left( k \right).}}\)
Trong phản ứng này nếu dùng 1 gam bột sắt thì phản ứng xảy ra nhanh hơn so với dùng một viên sắt có khối lượng 1 gam vì?
A.bột sắt xốp hơn so với sắt viên.
B.bột sắt có diện tích bề mặt nhỏ hơn.
C.bột sắt có diện tích bề mặt lớn hơn.
D.bột sắt mềm hơn.
Câu 28. Cho phản ứng:
\({N_{2\left( k \right)}} + 3{H_{2\left( k \right) \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} 2N{H_{3\left( k \right)}},\Delta H < 0.}}\)
Phản ứng xảy ra theo chiều thuận khi.
A.tăng nhiệt độ.
B.giảm áp suất của hệ phản ứng.
C.tăng nồng độ NH3.
D.tăng áp suất của hệ phản ứng.
Câu 29. Chỉ ra nhận định không đúng trong các nhận định sau?
A.Clorua vôi và nước Javen đều được dùng làm chất sát trùng, tẩy trắng sợi vải.
B.Al, Fe, Cr bị thụ động hóa trong axit sunfuaric đặc, nguội.
C.Trong phòng thí nghiệm, người ta điều chế oxi bằng cách nhiệt phân các chất giàu oxi và kém bền với nhiệt.
D.Các nguyên tố halogen đều tồn tại ở thể lỏng.
Câu 30. Hỗn hợp A chứa Mg và Cu. Cho m gam hỗm hợp A tác dụng với dung dịch HCl dư thì lượng khí không màu thu được là 2,24 lít (đktc). Cũng lượng hỗn hợp trên đem hòa tan trong dung dịch H2SO4 đặc, dư thì lượng khí SO2 thu được là 4,48 lít (đktc). Giá trị của m gần nhất với
A.8,0. B.8,5.
C.9,0. D.9,5.
Lời giải
|
Câu |
1 |
2 |
3 |
4 |
5 |
|
Đáp án |
B |
A |
A |
D |
B |
|
Câu |
6 |
7 |
8 |
9 |
10 |
|
Đáp án |
B |
B |
B |
D |
C |
|
Câu |
11 |
12 |
13 |
14 |
15 |
|
Đáp án |
A |
A |
C |
A |
A |
|
Câu |
16 |
17 |
18 |
19 |
20 |
|
Đáp án |
A |
A |
B |
D |
C |
|
Câu |
21 |
22 |
23 |
24 |
25 |
|
Đáp án |
C |
D |
A |
B |
C |
|
Câu |
26 |
27 |
28 |
29 |
30 |
|
Đáp án |
C |
C |
D |
D |
C |
Câu 2:
\({n_{NaBr}} = 0,05mol;{n_{NaCl}} = 0,02mol;{n_{NaF}} = 0,04mol\)
Các phương trình hóa học:
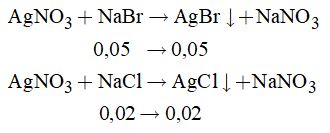
\(AgN{O_3} + NaF \to \) không phản ứng
Khối lượng kết tủa thu được là
\(m = {m_{AgBr}} + {m_{AgCl}} \)\(\,= 0,05.188 + 0,02.143,5 = 12,27\left( {gam} \right)\)
Đáp án A
Câu 4:
NaX (rắn) +H2SO4 (đặc) \( \to \) NaHSO4 +HX
Do HBr và HI là các chất có tính khử mạnh, do đó chúng không được điều chế theo phương trình trên.
Đáp án D
Câu 5:
+ Khi cho quỳ tím vào dung dịch NaOH loãng thì quỳ tím chuyển sang màu xanh.
+ Sục khí clo vào dung dịch, xảy ra phản ứng
\(C{l_2} + 2NaOH \to NaCl + NaClO + {H_2}O\)
Nước Javen
Dung dịch tạo thành là nước Javen có tính tẩy màu, do đó quỳ tím bị mất màu.
Đáp án B
Câu 6:
\(\eqalign{ & A.C{l_2} + 2KBr \to 2KCl + B{r_2} \cr & {\rm{B}}{\rm{.}}{{\rm{K}}_2}C{r_2}{O_7} + 14HC{l_{\left( d \right)}} \to 2KCl + 2CrC{l_2} + 4C{l_2} + 7{H_2}O \cr & C.NaC{l_{\left( r \right)}} + {H_2}S{O_{4\left( d \right)}} \to NaHS{O_4} + HCl \cr & {\rm{D}}{\rm{.B}}{{\rm{r}}_2} + {H_2}O + S{O_2} \to {H_2}S{O_4} + 2HBr \cr} \)
Vậy các phản ứng tạo ra đơn chất là (a) và (b)
Đáp án B
Câu 8:\({n_{{H_2}}} = \dfrac{V }{22,4} = 0,5\left( {mol} \right)\)
\(\eqalign{ & 2Al + 3{H_2}S{O_4} \to A{l_2}{\left( {S{O_4}} \right)_3} + 3{H_2}{\rm{ }}\left( 1 \right) \cr & Mg + {H_2}S{O_4} \to MgS{O_4} + {H_2}{\rm{ }}\left( 2 \right) \cr & Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2}{\rm{ }}\left( 3 \right) \cr} \)
Theo phương trình (1), (2), (3) ta thấy:
\({n_{{H_2}S{O_4}}} = {n_{{H_2}}} \Rightarrow {n_{{H_2}S{O_4}}} = 0,5\left( {mol} \right)\)
Áp dụng định luật bảo toàn khối lượng ta có:
\({m_{{\rm{dd}}}} = {m_{{H_2}S{O_4}}} = \) mmuối + \({m_{{H_2}}}\)
\( \Rightarrow \) mmuối = 17,5 + 0,5.98 – 0,5.2 = 65,5 gam
Đáp án A
Câu 9:
Quỳ tím ẩm
+ HCl: làm quỳ tím ẩm chuyển sang màu đỏ:
\(HCl\left( k \right) + {H_2}O \to HCl\left( {{\rm{dd}}} \right)\)
+ Cl2 làm quỳ tím ẩm chuyển sang màu đỏ sau đó mất màu.
\(C{l_2} + {H_2}O \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over {\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} HCl + HClO\)
+ H2: không hiện tượng.
Đáp án B
Câu 14:
\({n_{S{O_2}}} = \dfrac{V } {22,4}= 0,75\left( {mol} \right)\)
Gọi x, y lần lượt là số mol Al và Fe trong hỗn hợp nên: 27x + 56y = 22,2 (1)
Các quá trình xảy ra
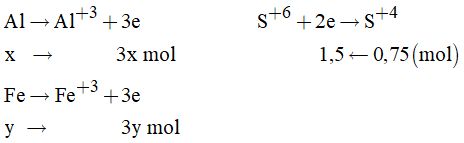
Áp dụng định luật bảo toàn electron ta có: 3x + 3y =1,5 (2)
Từ (1) và (2) ta có: x = 0,2; y = 0,3
\(\eqalign{ & \to \% Al = {{0,2.27} \over {22,2}}.100 = 24,23\% \cr & \to \% Fe = 100 - 24,32 = 75,68\% \cr} \)
Đáp án A
Câu 15:
Tăng nhiệt độ lên \(10^\circ C\) thì tốc độ của phản ứng tăng lên 2 lần \( \to \) hệ số nhiệt độ của phản ứng bằng 2.
Vậy khi giảm nhiệt độ từ \(70^\circ C\) đến \(40^\circ C\) thì tốc độ phản ứng giảm là \({2^{{{70 - 40} \over {10}}}} = {2^3} = 8\)
Đáp án
Câu 18:
\(\eqalign{ & {n_{{H_2}S}} = 0,2\left( {mol} \right);{n_{NaOH}} = 0,3\left( {mol} \right) \cr & Do{{{n_{NaOH}}} \over {{n_{{H_2}S}}}} = {3 \over 2} \Rightarrow 1 < {{{n_{NaOH}}} \over {{n_{{H_2}S}}}} < 2 \cr} \)
\( \Rightarrow \) sinh ra 2 muối Na2S và NaHS
\(\eqalign{ & NaOH + {H_2}S \to NaHS + {H_2}O\left( 1 \right) \cr & 2NaOH + {H_2}S \to N{a_2}S + {H_2}O\left( 2 \right) \cr} \)
Gọi x, y là số mol của H2S đã phản ứng ở (1) và (2)
Theo phương trình và đề bài ra ta có:
\(\left\{ \matrix{ x + y = 0,2 \hfill \cr x + 2y = 0,3 \hfill \cr} \right. \Leftrightarrow \left\{ \matrix{ x = 0,1 \hfill \cr y = 0,1 \hfill \cr} \right.\)
Vậy\({C_{{M_{NaHS}}}} = {C_{{M_{N{a_2}S}}}} = {{0,1} \over {0,2}} = 0,5M\)
Đáp án B
Câu 19:
\(2S{O_2}\left( k \right) + {O_2}\left( k \right) \to 2S{O_3}\left( k \right),\Delta H < 0.\)
Chọn phát biểu đúng trong các câu sah theo
A.Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ của SO3: Sai, vì khi giảm nồng độ của SO3, cân bằng sẽ chuyển dịch theo chiều tạo ra SO3 (chiều thuận).
B.Cân bằng chuyển dịch theo chiều thuận khi giảm áp suất của hệ phản ứng: Sai, vì khi giảm áp suất của hệ phản ứng, cân bằng chuyển dịch theo chiều nghịch.
C.Cân bằng chuyển dịch theo chiều thuận khi tăng nhiệt độ: Sai, vì \(\Delta H < 0\( nên chiều thuận là phản ứng tỏa nhiệt. Vậy khi tăng nhiệt độ thì cân bằng chuyển dịch theo chiều nghịch.
D.Cân bằng chuyển dịch theo chiều nghịch khi giảm nồng độ của O2: Đúng.
Đáp án D
Câu 22:
Gọi x là số mol axit H2SO4 đã phản ứng
\(\eqalign{ & ZnO + {H_2}S{O_4} \to ZnS{O_4} + {H_2}O{\rm{ }}\left( 1 \right) \cr & F{e_2}{O_3} + 3{H_2}S{O_4} \to F{e_2}{\left( {S{O_4}} \right)_3} + 3{H_2}O{\rm{ }}\left( 2 \right) \cr & FeO + {H_2}S{O_4} \to FeS{O_4} + {H_2}O{\rm{ }}\left( 3 \right) \cr} \)
Theo các phương trình (1), (2), (3) ta thấy: \({n_{{H_2}O}} = {n_{{H_2}S{O_4}}} = x\)
Áp dụng định luật bảo toàn khối lượng ta có:
\({m_{hh}} + {m_{{H_2}S{O_4}}} = \) mmuối + \({m_{{H_2}O}}\)
\(\eqalign{ & \Rightarrow 30,5 + 98x = 66,5 + 18x \cr&\Rightarrow x = 0,45\left( {mol} \right) \cr & \to a = {{0,45} \over {0,1}} = 4,5M \cr} \)
Câu 23:
\({n_{Mn{O_2}}} = 0,15\left( {mol} \right);\)
\({n_{NaOH}} = 0,4\left( {mol} \right)\)

Vậy các chất trong dung dịch sau phản ứng gồm NaCl, NaClO, NaOH dư
\(\eqalign{ & {C_{{M_{NaCl}}}} = {{0,15} \over {0,4}} = 0,375M;\cr&{\rm{ }}{{\rm{C}}_{{M_{NaClO}}}} = {{0,15} \over {0,4}} = 0,375M; \cr & {C_{{M_{NaOH}}}} = {{0,1} \over {0,4}} = 0,25M \cr} \)
Đáp án A
Câu 25:
Để thu được khí O2 tinh khiết ta phải dùng thuốc thử có thể tác dụng với các khí còn lại và không tạo ra khí nào khác ngoài khí O2
Dung dịch NaOH là thuốc thử tối ưu vì:
\(\eqalign{ & 2NaOH + C{l_2} \to NaCl + NaClO + {H_2}O \cr & 2NaOH + C{O_2} \to N{a_2}C{O_3} + {H_2}O \cr & 2NaOH + S{O_2} \to N{a_2}C{O_3} + {H_2}O \cr} \)
Đáp án C
Câu 28:
\({N_{2\left( k \right)}} + 3{H_{2\left( k \right)}} \rightleftarrows 2N{H_{3\left( k \right)}},\Delta H < 0\)
- Do \(\Delta H < 0\) nên chiều thuận phản ứng là phản ứng tỏa nhiệt. Vậy khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều nghịch.
- Khi giảm áp suất của hệ phản ứng thì cân bằng chuyển dịch theo chiều nghịch.
- Tăng nồng độ của NH3 thì cân bằng chuyển dịch theo chiều nghịch.
- Tăng áp suất của hệ phản ứng thì cân bằng chuyển dịch theo chiều thuận.
Đáp án D
Câu 30:
Cách 1: Tính toán theo phương trình phản ứng
\({n_{{H_2}}} = 0,1\left( {mol} \right)\)
Khi cho hỗn hợp tác dụng với HCl, các phản ứng xảy ra:
\(\eqalign{ & Mg + 2HCl \to MgC{l_2} + {H_2}{\rm{ }}\left( 1 \right) \cr & 0,1 \leftarrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ 0,1 mol}} \cr} \)
Cu + HCl \( \to \) không phản ứng
Khi cho hỗn hợp hòa tan trong dung dịch H2SO4 đặc, dư các phản ứng xảy ra:
\(\eqalign{ & Mg + {H_2}S{O_4} \to MgS{O_4} + S{O_2} + 2{H_2}O \cr & 0,1 \leftarrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\;\;\;{\rm{ 0,1 }}\left( {mol} \right) \cr & Cu + 2{H_2}S{O_4} \to CuS{O_4} + S{O_2} + {H_2}O \cr & 0,1 \leftarrow \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ 0,1 }}\left( {mol} \right) \cr} \)
Vậy khối lượng hỗn hợp A là:
\(m = 0,1.24 + 0,1.64 = 8,8\left( {gam} \right) \Rightarrow \) gần nhất với 9,0.
Đáp án C
Cách 2: Dùng phương pháp bảo toàn electron
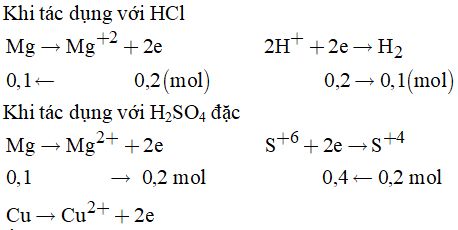
Áp dụng định luật bảo toàn elevctron ta có:
\(0,2 + 2.{n_{Cu}} = 0,4 \Rightarrow {n_{Cu}} = 0,1mol\)
Vậy m = 0,1.24 + 0,1.64 = 8,8 gam
Đáp án C
