Đề kiểm tra 45 phút (1 tiết) - Chương 6 - Đề số 1 - Hóa học 10
Câu 1. Chỉ ra câu sai trong các câu nhận xét sau
A.Lưu huỳnh vừa có tính oxi hóa, vừa có tính khử.
B.Hiđro sunfua vừa có tính khử, vừa có tính oxi hóa.
C.Lưu huỳnh trioxit là oxit axit tương ứng của axit H2SO4.
D.H2SO4 đặc, nóng có tính oxi hóa rất mạnh, có thể oxi hóa hầu hết các kim loại trừ Au, Pt.
Câu 2. Cho dãy các chất sau: Na2CO3, Ba(OH)2, Cu, Al, Fe2O3, KNO3, K2SO3. Số chất vừa tác dụng được với axit H2SO4 loãng, vừa tác dụng được với axit H2SO4 đặc, nóng là
A.3. B.4.
C.5. D.6.
Câu 3. Cho 9,6 gam kim loại R tan hoàn toàn trong H2SO4 đặc nóng dư thu được 3,36 lít SO2. Kim loại R là
A.Al. B.Cu.
C.Fe. D.Zn.
Câu 4. Chỉ ra phát biểu đúng trong các câu sau
A.Muốn pha loãng axit H2SO4 đặc ta rót nước vào axit.
B.Lưu huỳnh trioxit vừa có tính oxi hóa vừa có tính khử.
C.Hầu hết các muối sufat đều không tan.
D.Axit H2SO4 đặc có tính háo nước mạnh, nên khi sử dụng phải hết sức thận trọng.
Câu 5. Cho 13 gam kẽm tác dụng với 3,2 gam lưu huỳnh sản phẩm thu được sau phản ứng là
A.ZnS.
B. ZnS và S.
C.ZnS và Zn.
D. ZnS, Zn và S.
Câu 6. Hiđro sunfua có tính khử mạnh là do trong hợp chất H2S, nguyên tố lưu huỳnh có số oxi hóa
A. thấp nhất.
B. cao nhất.
C. trung gian.
D. không xác định được.
Câu 7. Cho 11,2 gam Fe và 6,4 gam Cu tác dụng với dung dịch H2SO4 loãng, dư. Sau phản ứng thu được V lít khí H2 ( đktc ). Giá trị của V là
A.2,24 lít. B.3,36 lít.
C.4,48 lít. D.6,72 lít.
Câu 8. Cho phương trình phản ứng:
\(S + 2{H_2}S{O_4}d/n \to 3S{O_2} + 2{H_2}O\)
Trong phản ứng trên, tỉ lệ giữa số nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hóa là
A. 1: 2. B. 1: 3.
C. 3: 1. D. 2: 1.
Câu 9. Cho 35,6 gam hỗn hợp Na2SO3 và NaHSO3 vào dung dịch H2SO4 loãng dư. Sau khi phản ứng kết thúc thấy khối lượng dung dịch tăng 16,4 gam và thu được V lít khí SO2 (đktc). Giá trị của V là
A.2,24. B.6,72.
C.8,96. D.11,2.
Câu 10. Khí không thu được bằng phương pháp dời nước là
A.O2. B.HCl.
C.N2. D.H2.
Câu 11. Để phân biệt ba chất bột: CaCO3, Na2CO3, BaSO4 có thể dùng
A. H2O, dung dịch NaOH.
B. H2O, dung dịch HCl.
C. H2O, dung dịch BaCl2.
D. Dung dịch BaCl2, dung dịch NaCl.
Câu 12. Dãy kim loại nào sau đây phản ứng được với H2SO4 đặc nguội
A.Zn, Al, Mg, Ca.
B.Cu, Cr, Ag, Fe.
C.Al, Fe, Ba, Cu.
D.Cu, Ag, Zn, Mg.
Câu 13. Hấp thụ hoàn tòn 12 gam lưu huỳnh trioxit vào 100 gam nước. Nồng độ phần trăm của dung dịch thu được là
A.12.00%. B.10,71%.
C.13,13%. D.14,7%.
Câu 14. Có các chất và dung dịch sau: NaOH (1), O2 (2), dung dịch Br2 (3), dung dịch CuCl2 (4), dung dịch FeCl2 (5). H2S có thể tham gia phản ứng với
A.1, 2, 3, 4, 5.
B.1, 2, 3, 4.
C.1, 2, 3.
D.1, 2, 5.
Câu 15. Hòa tan hoàn toàn 0,1 mol mỗi chất Fe, FeS và FeS2 trong dung dịch H2SO4 đặc nóng thu được V lít khí (đktc) SO2 sản phẩm khử duy nhất. Giá trị của V là
A.30,24 lít. B.20,24 lít.
C.33,26 lít. D.44,38 lít.
Câu 16. Nhận xét nào dưới đây không đúng?
A.H2SO4 đặc tác dụng với đường cho muội than.
B.Khí SO2 làm mất màu dung dịch Br2, dung dịch KMnO4.
C.Khi sục khí SO2 vào dung dịch bazo luôn thu được muối trung hòa.
D.Khí H2S tác dụng với FeCl3 tạo bột màu vàng.
Câu 17. Cho các nhận định sau:
1.SO2 vừa là chất oxi hóa, vừa là chất khử.
2.Phản ứng giữa H2S và SO2 dùng để thu hồi S trong các khí thải.
3.Ozon có tính khử mạnh và khử được Ag ở điều kiện thường.
4.Dẫn khí O3 qua dung dịch KI có hồ tinh bột, dung dịch có màu xanh.
5.NaHSO3 có tên natri hiđrosunfit.
6. FeCO3 tác dụng với H2SO4 loãng và H2SO4 đặc cho cùng 1 loại muối.
Số nhận định đúng là
A.3. B.6.
C.5. D.4.
Câu 18. Để đánh giá độ nhiễm bẩn không khí của một nhà máy, người ta tiến hanhfnhuw sau: Lấy 2 lít không khí rồi dẫn qua dung dịch Pb(NO3)2 dư thì thu được 0,3585 mg chất kết tủa màu đen. Điều này chứng tỏ trong không khí đã có chất khí nào sau đây?
A.NH3. B.H2S.
C.CO2. D.SO2.
Câu 19. Hấp thụ hoàn toàn 4,48 lít khí H2S vào 300 ml dung dịch KOH 1M. Tổng khối lượng muối thu được sau phản ứng là
A18,2 gam. B.22 gam.
C.21,6 gam. D.26 gam.
Câu 20. Cho phương trình:
\({\rm{aA}}l + b{H_2}S{O_4} \to cA{l_2}{\left( {S{O_4}} \right)_3} + dS{O_2} + e{H_2}O\)
Tỉ lệ a:b là?
A.2:3. B.1:1.
C.1:3. D.1:2.
Câu 21. Nung 4,8 gam bột lưu huỳnh với 6,5 gam bột kẽm. Sau khi phản ứng với hiệu suất 80% được hỗn hợp chất rắn X. Hòa tan X trong dung dịch HCl dư thu được V lít khí (đktc). Giá trị của V là
A.0,448. B.2,24.
C.3,36. D.1,792.
Câu 22. Cho phản ứng giữa lưu huỳnh với hiđro như hình vẽ sau, trong đó ống nghiệm 1 để tạo ra H2, ống nghiệm 2 dùng để nhận biết sản phẩm trong ống. Hãy cho biết hiện tượng quan sát được trong ống nghiệm 2?
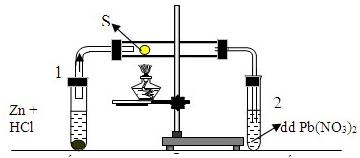
A.có kết tủa đen của PbS
B.dung dịch chuyển màu vàng do S tan vào nước.
C.có kết tủa tráng PbS.
D.có cả kết tủa trắng và dung dịch màu vàng xuất hiện.
Câu 23. Dùng một lượng dung dịch Ca(OH)2 vừa đủ để hấp thụ V lít khí SO2 (đktc) thu được 6 gam kết tủa. Lọc bỏ kết tủa cho tiếp một lượng dung dịch Ca(OH)2 dư vào phần nước lọc thì thu thêm 3 gam kết tủa nữa. Giá trị của V là
A.6,72 lít. B.4,48 lít.
C.2,24 lít. D.3,36 lít.
Câu 24. Từ năm 2003, nhờ bảo quản bằng nước ozon, mận Bắc Hà – Lào Cai đã có thể chuyên chở vào thị trường thành phố Hồ Chí Minh, nhờ đó bà con nông dân có thu hập cao hơn. Ứng dụng trên của ozon là nhờ tính chất nào sau đây?
A.Ozon dễ tan trong nước hơn oxi.
B.Ozon có tính chất oxi hóa mạnh, khả năng sát trùng cao về dễ tan trong nước hơn oxi.
C.Ozon không độc, có tính sát trùng cao.
D.Ozon không tác dụng với nước.
Câu 25. Trong tự nhiên có nhiều nguồn cung cấp oxi nhung có một quá trình luôn duy trì một cách ổn định là
A.quá trình quang hợp của cây xanh.
B.sự cháy các chất sinh ra.
C.từ nước biển.
D.sự phân hủy các chất giàu oxi.
Câu 26.Chỉ ra phát biểu đúng khi nói về muối sunfat?
A.Muối sunfat là muối axit sunfuhiđric.
B.Tất cả các muối sunfat đều tan tốt trong nước.
C.Có thể nhận biết muối sunfat bằng dung dịch muối bari hoặc dung dịch Ba(OH)2.
D.Các muối sunfat đều thể hiện tính oxi hóa.
Câu 27. Trong các khí sau, khí nào không thể làm khô bằng H2SO4 đặc?
A.SO2. B.CO2.
C.H2S. D.O2.
Câu 28. Tỉ khối của một hỗn hợp gồm oxi và ozon so với heli bằng 10,24. Thành phần phần trăm về thể tích của oxi và ozon là
A.44% và 56%.
B.35% và 75%.
C.40% và 60%.
D.45% và 55%.
Câu 29. Việc “đánh gió” để chữa bệnh cảm đã được ông bà ta sử dụng từ rất xa xưa cho đến tận bây giờ. Khi bị bệnh cảm, trong cở thể con người sẽ tích tụ một lượng khí H2S tương đối cao. Chính lượng H2S này làm cho cơ thể mệt mỏi. Khi ta dùng bạc để đánh gió, bạc sẽ tác dụng với khí H2S. Do đó lượng H2S trong cơ thể giảm dần sẽ hết bệnh. Dây Ag sau khi đánh gió sẽ có màu đen xám. Phản ứng hóa học xảy ra trong quá trình trên là
\(\eqalign{ & A.4Ag + 2{H_2}S + {O_2} \to 2AgS \downarrow + 2{H_2}O. \cr & B.Ag + S \to A{g_2}S. \cr & C.Ag + {O_2} \to A{g_2}O. \cr & D.Ag + {H_2}S \to A{g_2}S + {H_2}. \cr} \)
Câu 30. Hàm lượng SO2 có thể gây khó thở cho người bị hen suyễn, gây các bệnh về hô hấp và làm cho bệnh tim càng nặng hơn. SO2 phản ứng với những hạt này sẽ tụ tập trong phổi và gắn kết với nhau gây khó thở và dẫn đến nguy cơ tử vong. Dựa vào số oxi hóa của S trong SO2, có thể kết luận gì về tính chất của SO2?
A.Luôn là chất khử.
B.Là chất khử hoặc chất oxi hóa tùy vào tác nhân phản ứng.
C.Luôn là chất oxi hóa.
D.Không thể hiện tính oxi hóa, khử.
Lời giải
|
Câu |
1 |
2 |
3 |
4 |
5 |
|
Đáp án |
B |
C |
B |
D |
C |
|
Câu |
6 |
7 |
8 |
9 |
10 |
|
Đáp án |
A |
C |
A |
B |
B |
|
Câu |
11 |
12 |
13 |
14 |
15 |
|
Đáp án |
B |
D |
C |
B |
A |
|
Câu |
16 |
17 |
18 |
19 |
20 |
|
Đáp án |
C |
D |
B |
A |
C |
|
Câu |
21 |
22 |
23 |
24 |
25 |
|
Đáp án |
B |
A |
C |
B |
A |
|
Câu |
26 |
27 |
28 |
29 |
30 |
|
Đáp án |
C |
C |
A |
A |
B |
Câu 2:
Các chất đặc, nóng tác dụng với axit H2SO4 loãng là: Na2CO3, Ba(OH)2, Al, Fe2O3, K2SO3.
Các chất tác dụng với axit H2SO4 đặc, nóng là: Na2CO3, Ba(OH)2, Cu, Al, Fe2O3, K2SO3.
Vậy các chất vừa tác dụng với H2SO4 loãng vừa tác dụng với H2SO4 đặc nóng là Na2CO3, Ba(OH)2, Al, Fe2O3, K2SO3.
Đáp án C.
Câu 3:
Các quá trình xảy ra:
\(\eqalign{ & R \to {R^{ + a}} + ae\;\;\;\;\;\;\;\;\;{{\rm{S}}^{ + 6}} + 2e \to {S^{ + 4}} \cr & \;\;\;\;\;\;\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ 0,3}} \leftarrow {\rm{0,5 mol}} \cr} \)
Áp dụng định luật bảo toàn electron ta có: ne nhường = ne nhận
\( \to {n_R} = {{0,3} \over a}\left( {mol} \right)\)
Theo đề bài ta có:
\(\eqalign{ & {n_R} = {{9,6} \over {{M_R}}} = {{0,3} \over a} \cr & \to {M_R} = 32a \Rightarrow a = 2;{M_R} = 64\left( {Cu} \right) \cr} \)
Đáp án B
Câu 5:
\( {n_{Zn}} = 0,2mol;{n_S} = 0,1mol \)
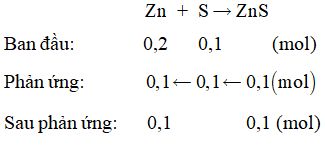
Vậy các chất thu được gồm ZnS và Zn dư.
Đáp án C.
Câu 7:
\({n_{Fe}} = 0,2mol;{n_{Cu}} = 0,1mol\)
Phương trình hóa học:
\(\eqalign{ & Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2} \cr & 0,2{\rm{ }}\;\;\;\;\;\; \to \;\;\;\;\;\;{\rm{ 0,2 }}\left( {mol} \right) \cr} \)
\(Cu + {H_2}S{O_4} \to \) không phản ứng
Vậy \(V = 0,2.22,4 = 4,48\) lít
Đáp án C.
Câu 8:
\(\eqalign{ & S + {H_2}S{O_4} \to 3S{O_2} + {H_2}O \cr & {S^0} \to {S^{ + 4}} + 4e{\rm{ }}{{\rm{S}}^{ + 6}} + 2e \to {S^{ + 4}} \cr} \)
Vậy tỉ lệ số nguyên tử bị khử (S+6) và số nguyên tử lưu huỳnh bị oxi hóa (S0) là 1:2
Đáp án A
Câu 9:
Dễ dàng nhận thấy khối lượng dung dịch tăng chính là sự chênh lệch khối lượng của hỗn hợp đưa vào và khí SO2 thoát ra.
\(\eqalign{ & 16,4 = {m_{hh}} - {m_{S{O_2}}} \cr&\to {m_{S{O_2}}} = 35,6 - 16,4 = 19,2\left( {gam} \right) \cr & \to {n_{S{O_2}}} = {m \over M} = {{19,2} \over {64}} = 0,3\left( {mol} \right) \cr} \)
Vậy \(V = 0,3.22,4 = 6,72 \) (lít)
Câu 11:
Hòa tan các chất vào nước ta nhận thấy:
+ Na2CO3 tan trong nước tạo dung dịch trong suốt.
+ CaCO3 và BaSO4 không tan.
Tiếp theo, dùng dung dịch HCl ta có thể nhận biết được:
+ CaCO3: chất rắn tan, sủi bọt khí.
+ BaSO4; không tan
Đáp án B.
Câu 13:
\(\eqalign{ & S{O_3} + {H_2}O \to {H_2}S{O_4} \cr & 80\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ 90 gam}} \cr & {\rm{12 }} \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,{\rm{ 14,7 gam}} \cr} \)
Khối lượng dung dịch sau phản ứng là:
mdd = 12 + 100 =112 gam.
Vậy \(C\% {H_2}S{O_4} = \dfrac{{{m_{ct}}}}{{{m_{{\text{dd}}}}}}.100\% \)\(\, = \dfrac{{14,7}}{{112}}.100 = 13,13\% {\text{ }}\)
Đáp án C.
Câu 15:
Cách 1: Dùng phương pháp bảo toàn electron
Các quá trình xảy ra:
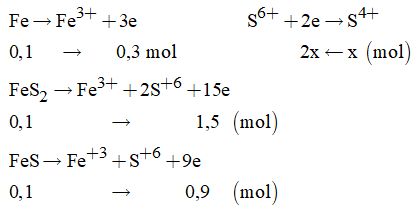
Áp dụng định luật bảo toàn electron ta có: ne nhường = ne nhận.
\(\eqalign{ & \to 2x = 0,3 + 0,9 + 1,5 \to x = 1,35mol \cr & \to V = 1,35.22,4 = 30,24\left( {lit} \right) \cr} \)
Đáp án A.
Cách 2: Tính toán theo phương trình hóa học:
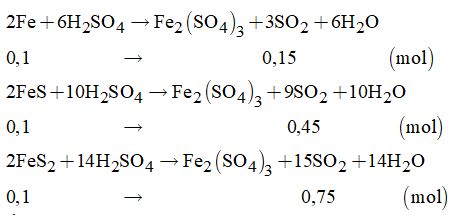
Tổng số mol SO2 thu được là:
\(\sum {{n_{S{O_2}}}} = 0,15 + 0,45 + 0,75 = 1,35\left( {mol} \right)\)
Thể tích SO2 thu được là: V = 1,35.22,4 = 30,24 (lít)
Câu 17:
(3) sai vì ozon có tính oxi hóa mạnh, có thể oxi hóa Ag ngay ở nhiệt độ thường:
\(Ag + {O_3} \to A{g_2}O + {O_2}\)
(6) sai vì
\(\eqalign{ & FeC{O_3} + {H_2}S{O_4}\left( l \right) \to FeS{O_4} + {H_2}O + C{O_2} \cr & 2FeC{O_3} + {H_2}S{O_4}\left( d \right) \to F{e_2}{\left( {S{O_4}} \right)_3} + 4{H_2}O + 2C{O_2} + S{O_2} \cr} \)
Vậy muối thu được trong 2 trường hợp là khác nhau.
Các nhận định đúng là (1), (2), (4), (5).
Đáp án D
Câu 19:
\(\eqalign{ & {n_{{H_2}S}} = 0,2\left( {mol} \right);{n_{KOH}} = 0,3\left( {mol} \right) \cr & \Rightarrow {{{n_{KOH}}} \over {{n_{{H_2}S}}}} = {3 \over 2} \Rightarrow 1 < {{{n_{KOH}}} \over {{n_{{H_2}S}}}} < 2 \cr} \)
\( \Rightarrow \) sinh ra 2 muối H2S
\(\eqalign{ & {H_2}S + 2KOH \to {K_2}S + 2{H_2}O{\rm{ }}\left( 1 \right) \cr & x{\rm{ }} \to {\rm{ 2x }} \to {\rm{x }}\left( {mol} \right) \cr & {H_2}S + KOH \to KHS + {H_2}O{\rm{ }}\left( 2 \right) \cr & y{\rm{ }} \to {\rm{y }} \to {\rm{ y }}\left( {mol} \right) \cr} \)
Theo phương trình và đề bài ra ta có:
\(\left\{ \matrix{ x + y = 0,2 \hfill \cr 2x + y = 0,3 \hfill \cr} \right. \Leftrightarrow \left\{ \matrix{ x = 0,1 \hfill \cr y = 0,1 \hfill \cr} \right.\)
Khối lượng muối thu được là:
\(m = {m_{{K_2}S}} + {m_{KHS}}\)\(\, = 0,1.110 + 0,1.72 = 18,2\left( {gam} \right)\)
Đáp án A
Câu 21:
\({n_S} = 0,15\left( {mol} \right);{n_{Zn}} = 0,1\left( {mol} \right)\)
Phương trình hóa học:
\(Zn{\rm{ + S}} \to ZnS\)
Ban đầu: 0,1 0,15
Nhận thấy: nZn < nS \( \Rightarrow \) hiệu suất phản ứng theo Zn
\( \to \) nZn phản ứng = 0,1.80% = 0,08 mol
Vậy hỗn hợp X gồm ZnS (0,08 mol); S (0,07 mol) và Zn (0,02 mol).
Hòa tan X trong dung dịch HCl
\(\eqalign{ & Zn + 2HCl \to ZnC{l_2} + {H_2} \cr & 0,02{\rm{ }} \to {\rm{ 0,02 }}\left( {mol} \right) \cr & {\rm{ZnS + 2HCl}} \to {\rm{ZnC}}{{\rm{l}}_2} + {H_2}S \cr & 0,08{\rm{ }} \to {\rm{ 0,08 }}\left( {mol} \right) \cr} \)
Thể tích H2 thu được là:
V = (0,02 + 0,08).22,4 = =2,24 (lít)
Đáp án B
Câu 22:
Ống nghiệm 1:
\(Zn + 2HCl \to ZnC{l_2} + {H_2}\)
Sau đó \({H_2} + S\buildrel {t^\circ } \over \longrightarrow {H_2}S\)
Trong ống nghiệm 2:
\({H_2}S + Pb{\left( {N{O_3}} \right)_2} \to PbS \downarrow + 2HN{O_3}\)
(đen)
Vậy hiện tượng quan sát được trong ống nghiệm (2) là có kết tủa màu đen.
Đáp án A
Câu 23:
\(n \downarrow \)trước = 0,05 mol;
\(n \downarrow \)sau = 0,025 mol
Căn cứ vào các dữ liệu đề bài ta thấy sục SO2 vào dung dịch Ca(OH)2 thì sinh ra hai muối.
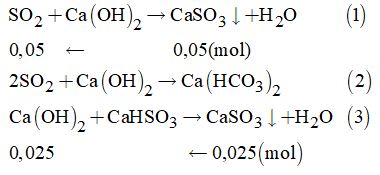
Theo (1), (2) và (3) ta có: \({n_{S{O_2}}} = 0,05 + 0,05 = 0,1\left( {mol} \right)\)
Thể tích SO2 cần dùng là: \(V = 0,1.22,4 = 2,24\) (lít)
Đáp án C
Câu 28:
\({d_{hh/He}} = 10,24\)
\(\Rightarrow \overline {{M_{hh}}} = 10,24.4 = 40,96\)
Xét trong 1 mol hỗn hợp khí.
Gọi x là số mol của O2 trong hỗn hợp
\(\eqalign{ & \Rightarrow {n_{{O_3}}} = 1 - x\left( {mol} \right) \cr & \overline {{M_{hh}}} = 32.x + 48\left( {1 - x} \right) \cr & \to 32x + 48 - 48x = 40,96\cr& \to x = 0,44\left( {mol} \right) \cr} \)
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ về phần trăm thể tích cũng là tỉ lệ về số mol
\(\eqalign{ & \Rightarrow \% {V_{{O_2}}} = \% {n_{{O_2}}} = {{0,44} \over 1}.100\% = 44\% \cr & \Rightarrow {V_{{O_3}}} = 100\% - 44\% = 56\% \cr} \)
Đáp án A.
- Bài 29. Oxi - ozon
- Bài 30. Lưu huỳnh
- Bài 31. Bài thực hành số 4: Tính chất của oxi, lưu huỳnh
- Bài 32. Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit
- Bài 33. Axit sunfuric - Muối sunfat
- Bài 34. Luyện tập oxi và lưu huỳnh
- Bài 35. Bài thực hành số 5: Tính chất các hợp chất của lưu huỳnh
- Đề kiểm tra 15 phút - Chương 6 - Hóa học 10
- Đề kiểm tra 45 phút (1 tiết) - Chương 6 - Hóa học 10
