Đề số 11 - Đề kiểm tra học kì 1 - Hóa học 11
I. PHẦN TRẮC NGHIỆM
Câu 1. Nếu lấy 2 dung dịch NaOH và CH3COONa có cùng giá trị pH thì phép so sánh nồng độ CM của hai dung dịch trên đúng là:
\(\begin{array}{l}A.{C_{{M_{NaOH}}}} = {C_{{M_{C{H_3}{\rm{COONa}}}}}}\\B.{C_{{M_{NaOH}}}} < {C_{{M_{C{H_3}{\rm{COONa}}}}}}\\C.{C_{{M_{NaOH}}}} > {C_{{M_{C{H_3}{\rm{COONa}}}}}}\\D.2{C_{{M_{NaOH}}}} = {C_{{M_{C{H_3}{\rm{COONa}}}}}}\end{array}\)
Câu 2. Dãy chất và ion nào sau đây là lưỡng tính rheo Bronstest?
\(\begin{array}{l}A.Cu{\left( {OH} \right)_2};Be{\left( {OH} \right)_2};A{l_2}{O_3};HSO_4^ - \\B.HSO_3^ - ;Zn{\left( {OH} \right)_2};A{l_2}{O_3};NaHC{O_3}\\C.{K_2}S;FeC{l_3};Zn{\left( {OH} \right)_2};Cu{\left( {OH} \right)_2}\\D.HSO_4^ - ;AlC{l_3};A{l_2}{O_3};Cu{\left( {OH} \right)_2}\end{array}\)
Câu 3. Một dung dịch bazo mạnh Ba(OH)2 có nồng độ \(\left[ {B{a^{2 + }}} \right] = {5.10^{ - 5}}\) mol/l. Giá trị pH của dung dịch trên là:
A.10 B.9
C.8 D.7
Câu 4. Để điều chế khí N2 từ dung dịch NaNO2 và NH4Cl bão hòa thì người ta đun nóng bình cầu như thế nào?
A.Ban đầu đun nhẹ, sau đó đun mạnh dần.
B.Ban đầu đun mạnh, sau đó đun yếu dần.
C.Đun mạnh liên tục cho đến khi phản ứng xảy ra hoàn toàn.
D.Ban đầu đun nhẹ, khi có bọt khí thoát ra thì ngừng đun.
Câu 5. Phản ứng nhiệt phân muối nitrat nào sau đây là không đúng?
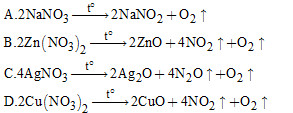
Câu 6. Khi cho Fe tác dụng với dung dịch hỗn hợp muối gồm AgNO3, Cu(NO3)2, Pb(NO3)2 thì Fe khử các ion kim loại theo thứ tự là?
\(\begin{array}{l}A.A{g^ + },P{b^{2 + }},C{u^{2 + }}\\B.A{g^ + },C{u^{2 + }},P{b^{2 + }}\\C.C{u^{2 + }};A{g^ + };P{b^{2 + }}\\D.P{b^{2 + }},A{g^ + };C{u^{2 + }}\end{array}\)
Câu 7. Dẫn 2,24 lít khí CO2 (đktc) vào 100ml dung dịch KOH 1,5M. Dung dịch thu được chứa những chất nào sau đây?
A.KHCO3 và K2CO3
B.K2CO3
C.KHCO3
D.K2CO3 và KOH
Câu 8. Cho 0,53 gam muối cacbonat (X) của hai kim loại hóa trị I tác dụng với dung dịch HCl dư thu được 112ml khí CO2 (đktc). Công thức muối (X) là:
A.KHCO3 B.Na2CO3
C.K2CO3 D.NaHCO3
Câu 9. Cho bột than dư vào hỗn hợp gồm Fe2O3 và CuO nung nóng để phản ứng xảy ra hoàn toàn thu được 2 gam hỗn hợp kim loại và 2,24 lít khí (đktc). Khối lượng hỗn hợp oxit ban đầu là:
A.5,00 gam B.5,15 gam
C.5,20 gam D.5,30 gam
Câu 10. Đốt cháy hoàn toàn 4,5 gam hỗn hợp chất hữu cơ (X) thu được 13,2 gam CO2 và 8,1 gam H2O. Công thức phân tử của (X) là:
A.CH4O B.CH4
C.C2H6 D.C2H6O
Câu 11. Dẫn toàn bộ sản phẩm khi đốt cháy hoàn toàn 1,48 gam chất hữu cơ (X) lần lượt vào bình (I) chứa H2SO4 đặc và bình (II) chứa KOH đặc thì thấy khối lượng bình (I) tăng 1,8 gam và bình (II) tăng 3,52 gam. Công thức phân tử của (X) là:
A.C3H8 B.C5H12
C.C4H8 D.C4H10O
Câu 12. Đốt cháy hoàn toàn a gam một hiđrocacbon. Dẫn toàn bộ sản phẩm vào bình nước vôi trong dư, thấy khối lượng của bình tăng 7,44 gam và thu được 12 gam kết tủa. Giá trị của a là:
A.1,68 gam B.1,50 gam
C.0,12 gam D.0,24 gam
II. PHẦN TỰ LUẬN
Câu 13. Biết dung dịch axit CH3COOH có \({K_{C{H_3}COOH}} = 1,{8.10^{ - 5}}.\) Tính độ điện li \(\alpha \) của CH3COOH 0,1M đã cho ở trên.
Câu 14. Một bình kín dung tích 0,5 lít có chứa 0,5 mol H2 và 0,5 mol N2. Khi phản ứng đạt trạng thái cân bằng thấy có 0,02 mol NH3. Xác định hằng số cân bằng của phản ứng tổng hợp NH3 ở trên.
Câu 15. Cho 8,9 gam hỗn hợp muối cacbonat của hai kim loại kiềm thuộc hai chu kì kế tiếp nhau tác dụng hết với dung dịch HCl thu được 2,24 lít khí CO2 (đktc). Xác định khối lượng muối thu được sau phản ứng.
Câu 16. Cho biết độ tan của CaSO4 là 0,2 gam trong 100ml nước (ở \(20^\circ C\)) và khối lượng riêng của dung dịch bão hòa là D = 1 g/ml. Hỏi khi trộn 50ml dung dịch CaCl2 0,012M với 150ml dung dịch Na2SO4 0,04M (ở \(20^\circ C\)), có xuất hiện kết tủa hay không?
Lời giải
I. PHẦN TRẮC NGHIỆM
|
Câu |
1 |
2 |
3 |
4 |
|
Đáp án |
B |
B |
A |
D |
|
Câu |
5 |
6 |
7 |
8 |
|
Đáp án |
C |
B |
A |
B |
|
Câu |
9 |
10 |
11 |
12 |
|
Đáp án |
C |
C |
D |
A |
II. PHẦN TỰ LUẬN
Câu 13.
\(\begin{array}{l}C{H_3}COOH \mathbin{\lower.3ex\hbox{\(\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}\)}} C{H_3}CO{O^ - } + {H^ + }\\{\rm{ }}\left( {0,1 - x} \right){\rm{ \;\;\;\;\;\; \;\;\;\; x \;\;\;\;\;\;\;\; \;\;\;\;\;\; x }}\left( M \right)\end{array}\)
Ta có: \(K = \dfrac{{\left[ {{H^ + }} \right].\left[ {C{H_3}CO{O^ - }} \right]}}{{\left[ {C{H_3}COOH} \right]}} \)\(\,= 1,{8.10^{ - 6}} = \dfrac{{{x^2}}}{{0,1 - x}}\)
Giả sử \(x \ll 0,1 \Rightarrow 0,1 - x \approx 0,1 \)
\(\Rightarrow {x^2} = 1,{8.10^{ - 6}} \Rightarrow x = 1,{34.10^{ - 3}}.\)
Vậy: \(\alpha = \dfrac{{1,{{34.10}^{ - 3}}}}{{{{10}^{ - 1}}}} = 1,34\% \)
Câu 14.
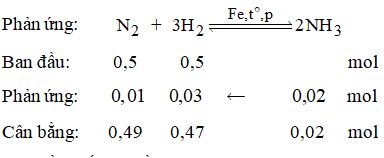
Vậy hằng số cân bằng là:
\(K = \dfrac{{{{\left[ {N{H_3}} \right]}^2}}}{{\left[ {{N_2}} \right]{{\left[ {{H_2}} \right]}^3}}} \)\(\,= \dfrac{{{{\left( {\dfrac{{0,02}}{{0,5}}} \right)}^2}}}{{{{\left( {\dfrac{{0,47}}{{0,5}}} \right)}^3}\left( {\dfrac{{0,49}}{{0,5}}} \right)}} = 1,{97.10^{ - 3}}\)
Câu 15.
Gọi công thức tương đương của hai muối có dạng \({\overline R _2}C{O_3}\)
Ta có: \({n_{C{O_2}}} = \dfrac{{2,24}}{{22,4}} = 0,1\left( {mol} \right)\)
Phản ứng:
\(\begin{array}{l}{\overline R _2}C{O_3} + 2HCl \to 2\overline R Cl + C{O_2} \uparrow + {H_2}O{\rm{ }}\left( 1 \right)\\{\rm{ 0,1 \;\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \;\;\;\;\,\,\,\,\,\,\,\,\,\,\,\, 0,2 }} \leftarrow {\rm{\,\,\,\,\,\,\,0,1 }}\left( {mol} \right)\end{array}\)
Từ (1) \( \Rightarrow {M_{{{\overline R }_2}C{O_3}}} = \dfrac{{8,9}}{{0,1}} = 89 \)
\(\Leftrightarrow 2\overline R + 60 = 89 \Rightarrow \overline R = 14,5\)
Vậy mmuối \( = {m_{{{\overline R }_2}C{O_3}}} = 0,2\left( {\overline R + 35,5} \right) \)\(\,= 0,2\left( {14,5 + 35,5} \right) = 10\left( {gam} \right)\).
Câu 16.
Ta có: \({n_{CaC{l_2}}} = 0,15 \times 0,012 = 0,006\left( {mol} \right)\)
Và \({n_{N{a_2}S{O_4}}} = 0,15 \times 0,04 = 0,006\left( {mol} \right)\)
Nếu 2 chất đó phản ứng hoàn toàn ta được:
\(\begin{array}{l}CaC{l_2} + N{a_2}S{O_4} \to CaS{O_4} + 2NaCl{\rm{ }}\left( 1 \right)\\0,006 \to {\rm{ \;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\;\; 0,006 }}\left( {mol} \right)\end{array}\)
Từ (1) \( \Rightarrow {n_{CaS{O_4}}} = 0,0006\left( {mol} \right)\)
\( \Rightarrow {m_{CaS{O_4}}} = 0,006 \times 136 = 0,0816\left( {gam} \right)\)
Trong 200ml dung dịch CaSO4 bão hòa có:
\({n_{CaS{O_4}}} = \dfrac{{0,2 \times 200}}{{100}} = 0,4\left( {gam} \right)\)
Vì 0,0815 (gam) < 0,4 (gam): nên dung dịch trên chưa bão hòa và sẽ không có kết tủa CaSO4.
- Đề số 1 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 2 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 3 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 4 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 5 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 6 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 7 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 8 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 9 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 10 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 11 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 12 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 13 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 14 - Đề kiểm tra học kì 1 - Hóa học 11
- Đề số 15 - Đề kiểm tra học kì 1 - Hóa học 11
