I. PHẦN CHUNG: (8,0 điểm) Dành cho tất cả các thí sinh
Câu 1: (2,0 điểm)
Hoàn thành các phương trình hóa học sau dưới dạng phân tử và phương trình ion rút gọn:
a) KOH + HCl →
b) Ca(NO3)2 + Na2CO3 →
Câu 2: (2,0 điểm)
Bằng phương pháp hóa học hãy phân biệt các dung dịch bị mất nhãn sau: Ba(NO3)2, Na3PO4, KCl, NaNO3
Câu 3: (2,0 điểm)
Viết các phương trình phản ứng hóa học thực hiện chuỗi phản ứng sau:
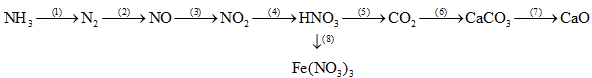
Câu 4: (2,0 điểm)
Cho 1,2 gam hỗn hợp X gồm Mg và MgO tác dụng hoàn toàn với 39,4 gam dung dịch HNO3 loãng thì thu được 0,448 lít khí NO (đktc) (sản phẩm khử duy nhất) và dung dịch A.
a) Tính thành phần phần trăm theo khối lượng mỗi chất có trong 1,2 gam hỗn hợp X.
A. 70% và 30%. B. 60% và 40%.
C. 50% và 50%. D. 20% và 80%.
b) Tính nồng độ phần trăm của muối có trong dung dịch A.
A. 14,54% B. 16,54%
C. 14,45% D. 15,54%
II. PHẦN TỰ CHỌN: (2,0 điểm) Thí sinh chỉ được chọn một trong hai câu: Câu 5A hoặc Câu 5B để làm bài
Câu 5A: (2,0 điểm) Theo chương trình chuẩn
Đốt cháy hoàn toàn 1,48 gam một hợp chất hữu cơ sau phản ứng thu được 3,52 gam CO2 và 1,8 gam H2O
a) Tìm công thức đơn giản nhất của hợp chất hữu cơ.
A. C4H10O. B. C2H5O.
C. CH4O. D. C2H4O.
b) Tìm công thức phân tử của hợp chất hữu cơ biết khi hóa hơi 7,4 gam hợp chất hữu cơ có thể tích đúng bằng thể tích của 3,2 gam oxi (đo ở cùng điều kiện nhiệt độ, áp suất)
A. C2H6O. B. C2H4O.
C. C4H10O. D. C3H6O2.
Câu 5B: (2,0 điểm) Theo chương trình nâng cao
Cho dung dịch X có chứa axit HCOOH 0,1M có hằng số phân li là Ka = 1,6.10-4 (Bỏ qua sự điện li của H2O)
a) Tính pH của dung dịch X.
A. 2,4. B. 2,2.
C. 2,6. D. 2,3.
b) Tính độ điện li của HCOOH.
A. 3,29%. B. 3,92%.
C. 2,93%. D. 2,39%.
c) Khi cho 5,85 gam NaCl vào dung dịch X thì độ điện li của HCOOH như thế nào? Giải thích?
A. Tăng.
B. Giảm.
C. Tăng sau đó giảm dần.
D. Không đổi.