a) Gọi khối lượng nguyên tử của M là M.
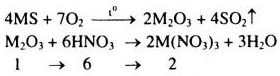
Xét 1 mol \({M_2}{O_3}\)
Khối lượng dung dịch \(HN{O_3}\) đã dùng: \({m_{{\rm{dd}}HN{O_3}}} = \frac{{6.63.100}}{{37,8}} = 1000(g)\)
Khối lượng dung dịch thu được sau phản ứng:
\({m_{{\rm{dd}}}} = {m_{{M_2}{O_3}}} + {m_{{\rm{dd}}HN{O_3}}} \)
\(= 1.(2M + 48) + 1000 = (2M + 1048)(g)\)
Khối lượng muối thu được sau phản ứng: \({m_{ct}} = {m_{M{{(N{O_3})}_3}}} = 2.(M + 186)(g)\)
Theo đề bài ta có: \({C_\% } = \frac{{{m_{ct}}.100}}{{m{\rm{dd}}}} \Rightarrow 41,7 = \frac{{2(M + 186).100}}{{2M + 1048}}\)
\( \Rightarrow M = 56g/mol(Fe)\)
b)
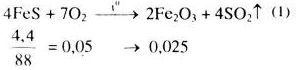
\(F{e_2}{O_3} + 6HN{O_3} \to 2Fe{(N{O_3})_3} + 3{H_2}O\) (2)
\(0,025 \to 0,15\)
Từ (1) và (2) \( \Rightarrow {n_{HN{O_3}}}\) = 0,15 mol
Khối lượng dung dịch \({HN{O_3}}\) 37,8% đã dùng là:
\({m_{{\rm{dd}}}} = \frac{{0,15.63.100}}{{37,8}} = 25(g)\)