a) Các phựơng trình hoá học :
\(CuO + CO\buildrel {{t^o}} \over\longrightarrow Cu + C{O_2}(1)\)
\(FeO + CO\buildrel {{t^o}} \over\longrightarrow Fe + C{O_2} \uparrow (2)\)
\(CuO + {H_2}\buildrel {{t^o}} \over\longrightarrow Cu + {H_2}O(3)\)
\(FeO + {H_2}\buildrel {{t^o}} \over\longrightarrow Fe + {H_2}O(4)\)
b) Theo các phương trình hoá học (1), (2), (3), (4) số mol nguyên tử oxi trong oxit mất đi bằng số mol CO hay H2 tham gia.
Vậy khối lượng chất rắn giảm : \(\dfrac{80}{{100}}\times 16 = 4,8(g);m = 4,8(g)\)
c) Gọi số mol H2, CO trong 1 mol hỗn hợp lần lượt là x mol và y mol
\({\overline M _{hh}} = 0,45 \times 16 = 7,2\)
Áp dụng phương pháp đường chéo ta có:
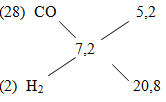
=> \(\dfrac{{{n_{CO}}}}{{{n_{{H_2}}}}} = \dfrac{{5,2}}{{20,8}} = \dfrac{1}{4}\)
Ta có : \({V_{{H_2}}} = \dfrac{{4 \times 100\% }}{5} = 80\% ;\% {V_{CO}} = 20\% \)