ĐỀ KIỂM TRA HỌC KÌ 2 (ĐỀ THI HỌC KÌ 2) - HÓA HỌC 12
Bài Tập và lời giải
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Cho dung dịch \(Ba{(OH)_2}\) dư vào 100 ml dung dịch \(NaHC{O_3}\,1M;\,N{a_2}C{O_3}\,0,5M\) thì thu được số gam kết tủa là
A. 19,7 gam.
B. 24,625 gam.
C. 29,55 gam.
D. 34,475 gam.
Câu 2. Dung dịch \(Ba{(OH)_2}\) có thể phản ứng được với tất cả các chất của dãy nào sau đây?
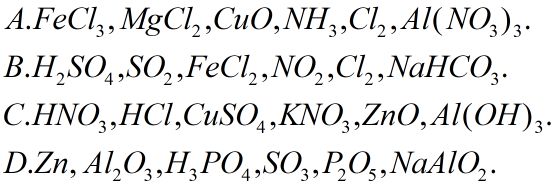
Câu 3. Dùng phương pháp nào sau đây chắc chắn phân biệt được nước cứng tạm thời và nước cứng vĩnh cửu?
A. Cho vào một ít nước vôi trong.
B. Cho vào một ít xôđa \((N{a_2}C{O_3}).\)
C. Đun nóng.
D. Cho vào một ít natri photphat.
Câu 4. Thí nghiệm nào sau đây thu được \(Al{(OH)_3}\) nhiều nhất? (lượng chất chứa nhôm lấy như nhau).
A. Cho bột nhôm tác dụng với nước.
B. Điện phân dung dịch muối nhôm clorua.
C. Cho dung dịch muối nhôm tác dụng với dung dịch kiềm dư.
D. Thổi khí HCl dư vào dung dịch natri aluminat.
Câu 5. Cho các chất: \(AlC{l_3},\,NaHC{O_3},AlOH{)_3},\)\(N{a_2}C{O_3},Al.\) Số chất trong dãy đều tác dụng được với axit HCl, dung dịch NaOH là
A. 4.
B. 5.
C. 3.
D. 2.
Câu 6. Phương trình ion rút gọn: \(2C{l^ - } + 2{H_2}O \to 2O{H^ - } + {H_2} + C{l_2}\) xảy ra khi nào?
A. Cho NaCl vào nước.
B. Điện phân dung dịch NaCl có màng ngăn xốp.
C. Đun sôi dung dịch NaCl.
D. Điện phân nóng chảy NaCl.
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm).
Cho sơ đồ chuyển hóa (các phản ứng xảy ra hoàn toàn, mỗi chuyển hóa đã có \( \ge 1\) phản ứng xảy ra)
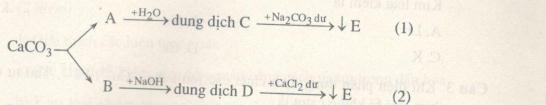
So sánh khối lượng kết tủa của E trong hai trường hợp (1) và (2). Viết các phương trình phản ứng minh họa.
Câu 2. (2 điểm)
a) Từ \(NaCl,CaC{O_3},{H_2}O.\) Viết các phương trình phản ứng điều chế: \(N{a_2}C{O_3},CaC{l_2}.\)
b) Nêu hiện tượng xảy ra và viết các phương trình phản ứng minh họa khi cho mẩu nhỏ Na vào dung dịch \(CuS{O_4}.\)
Câu 3. (3 điểm)
Cho 7,7 gam hỗn hợp bột Na và Al vào 500 ml dung dịch NaOH 0,5M, sau khi phản ứng kết thúc thu được dung dịch A và 7,84 lít khí hiđro (đktc).
1) Tính khối lượng mỗi kim lọa trong hỗn hợp ban đầu.
2) Tính thể tích dung dịch HCl 0,5M cần thêm vào dung dịch A để:
a) Thu được lượng kết tủa lớn nhất
b) Thu được 7,8 gam kết tủa sau khi kết tủa đạt cực đại.
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Hóa chất nào sau đây có thể dùng đồng thời làm mềm nước cứng tạm thời và nước cứng vĩnh cửu?
\(\begin{array}{l}A.\,Ca{(OH)_2}\\B.\,N{a_2}C{O_3}\\C.\,C{a_3}{(P{O_4})_2}\\D.\,HCl\end{array}\)
Câu 2. Người ta điện phân nóng chảy muối halogenua của một kim loại thì thu được 62,79 gam kim loại ở catot và 18,032 lít khí bay ra ở anot (đktc). Kim loại kiềm là
A. Li.
B. Na.
C. K.
D. Cs.
Câu 3. Khi điện phân dung dịch chứa các ion: \(A{g^ + },C{u^{2 + }},F{e^{3 + }}.\) Thứ tự các ion kim loại bị khử ở catot là
\(\begin{array}{l}A.\,A{g^ + } > C{u^{2 + }} > F{e^{3 + }}.\\B.\,F{e^{3 + }} > A{g^ + } > C{u^{2 + }} > F{e^{2 + }}.\\C.\,A{g^ + } > F{e^{3 + }} > C{u^{2 + }}.\\D.\,A{g^ + } > F{e^{3 + }} > C{u^{2 + }} > F{e^{2 + }}.\end{array}\)
Câu 4. Bột Al hòa tan được dung dịch nào sau đây?
\(\begin{array}{l}A.\,{H_2}S{O_4}.\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,B.\,N{a_2}C{O_3}.\\C.\,N{H_4}Cl.\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,D.\,N{H_3}.\end{array}\)
Câu 5. Thông tin nào sau đây không đúng?
A. Muối Cr(III) trong môi trường \({H^ + }\) dễ bị khử thành muối Cr(II).
B. Muối Cr(III) trong môi trường \(O{H^ - }\) dễ bị oxi hóa thành muối Cr(VI).
C. Hợp chất Cr(VI) là những chất oxi hóa mạnh.
D. Hợp chất \(Cr{O_3}\) tan trong nước tạo thành dung dịch axit cromic.
Câu 6. Khi hòa tan oxit màu đỏ gạch của một kim loại hóa trị I trong \(HN{O_3},\) thấy có khí không màu hóa nâu ngoài không khí. Vậy kim loại trong oxit có thể là
A. K
B. Cu.
C. Na.
D. Ag.
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm)
1. Kim loại X rất cứng, tan trong HCl dư đun nóng thu được dung dịch Y. X phản ứng với \(C{l_2}\) rồi hòa tan vào nước được dung dịch z. Thêm tiếp NaOH dư vào Z thấy có kết tủa sau đó kết tủa tan hoàn toàn. Tìm kim loại X và viết các phương trình phản ứng xảy ra.
2. Một lá kim loại Pt bị bám một lớp đồng trên bề mặt. Có thể làm sạch lá Pt bằng cách dùng dung dịch nào trong số các dung dịch sau: \((I)AgN{O_3}\) dư, \((II)HN{O_3}\) loãng dư?
Câu 2. (2 điểm)
1. Giải thích các hiện tượng sau:
a) Các kim loại kiềm phải đảm bảo bằng cách ngâm trong dầu hỏa.
b) Kim loại nhôm nguyên chất tác dụng được với nước nhưng không tan trong nước.
2. Viết các phương trình phản ứng theo sơ đồ:
\(Fe \to FeO \to Fe{(N{O_3})_3} \to Fe{(OH)_3}\)\(\, \to F{e_2}{O_3}\)
Câu 3. (3 điểm)
Chia 20 gam hỗn hợp X gồm Al, Fe, Cu thành hai phần bằng nhau. Phần 1 tác dụng hết với dung dịch HCl thu được 5,6 lít khí (đktc). Phần 2 cho vào dung dịch NaOH dư thu được 3,36 lít khí (đktc).
1. Tính % khối lượng mỗi kim loại có trong hỗn hợp ban đầu.
2. Cho hỗn hợp trên tác dụng với \(HN{O_3}\) đặc, nguội dư được chất khí X màu nâu (sản phẩm khử duy nhất). Tính thể tích khí X (đktc).
I. PHẦN TRẮC NGHIỆM (3 điểm)
Câu 1. Phản ứng hóa học nào sau đây không xảy ra?
A.2KOH+H2S→2KHS
B.K2CO3+CO2+H2O→2KHCO3
C.2KOH+MgCO3→K2CO3+Mg(OH)2↓
D.KCl+AgNO3→KNO3+AgCl↓
Câu 2. Khi điện phân dung dịch hỗn hợp gồm: \(AgN{O_3};Cu{(N{O_3})_2};Fe{(N{O_3})_2}\) với điện cực trơ. Các kim loại lần lượt xuất hiện ở catot là
A. Ag, Cu, Fe.
B. Fe, Ag, Cu.
C. Fe, Cu, Ag.
D. Cu, Ag, Fe.
Câu 3. Nhúng thanh kim loại kẽm vào một dung dịch chứa hỗn hợp 3,2 gam \(CuS{O_4}\) và 6,24 gam \(CdS{O_4}.\) Sau khi Cu và Cd (M = 12 g/mol) bị đẩy hoàn toàn khỏi dung dịch thì khối lượng thanh kim loại là
A. tăng 1,39 gam
B. giảm 1,39 gam.
C. tăng 4 gam.
D. kết quả khác.
Câu 4. Dung dịch NaOH có thể phản ứng được với tất cả các chất nào các dãy sau đây?
A. FeCl3, MgCl2, CuO, NH3, Br2, Al(NO3)3.
B. H2SO4, CO2, FeCl2, NO2, Cl2, NaHCO3.
C. HNO3, HCl, CuSO4, KNO3, ZnO, Al(OH)3.
D. Zn, Al2O3, H3PO4, SO3, P2O5, NaAlO2.
Câu 5. Dung dịch nào sau đây không hoàn tan được đồng kim loại?
A. Dung dịch \(FeC{l_3}.\)
B. Dung dịch HCl.
C. Dung dịch hỗn hợp \(NaN{O_3}\) và HCl.
D. Dung dịch axit \(HN{O_3}.\)
Câu 6. Để sát trùng, tẩy uế xung quanh khu vực bị ô nhiễm, người ta thường rải lên đó những chất bột màu trắng, mùi hắc. Chất bột là
\(\begin{array}{l}A.\,Ca{(OH)_2}.\\B.\,CaOC{l_2}.\\C.\,CaC{O_3}.\\D.\,CaO\end{array}\)
II. PHẦN TỰ LUẬN (7 điểm)
Câu 1. (2 điểm)
1. Nêu phương pháp hóa học nhận biết các chất khí không màu: \({H_2}S,S{O_2},C{O_2}.\)
2. Kể tên (hoặc công thức phân tử) hóa chất cho mỗi trường hợp sau (mỗi trường hợp 2 chất):
a) Chất gây mưa axit.
b) Chất gây nghiện.
c) Phân bón hóa học.
d) Nhiên liệu
Câu 2. (2 điểm)
1. Viết phương trình phản ứng xảy ra trong mỗi thí nghiệm sau:
a) Cho hỗn hợp Al và K vào nước.
b) Cho hỗn hợp \(F{e_3}{O_4}\) và Cu vào \({H_2}S{O_4}\) loãng.
2. Viết các phương trình phản ứng theo sơ đồ sau:
\(Cr \to CrC{l_3} \to CrC{l_2} \to Cr{(OH)_2} \)\(\to Cr{(OH)_3}\)
Câu 3. (3 điểm)
Nhiệt phân hết 55 gam hỗn hợp muối cacbonat của 2 kim loại hóa trị 2 thu được khí \(C{O_2}.\) Cho khí này hấp thụ hoàn toàn vào 1 lít dung dịch NaOH 0,7M, sau phản ứng đem cô cạn thu được 46,4 gam chất rắn.
1. Chứng minh rằng chất rắn gồm hai muối \(N{a_2}C{O_3}\) và \(NaHC{O_3}.\)
2. Tìm hai muối cacbonat ban đầu. Biết hai kim loại trong muối là hai kim loại liên tiếp tronh nhóm IIA.
